美国传来新冠疫苗的好消息
美国制药巨头辉瑞公司(Pfizer)在官网发布消息称,其与德国生物新技术公司(BioNTech)合作研发的mRNA新冠候选疫苗BNT162b2在没有感染新冠病毒的参与者身上,已经证明了超过90%的有效性。
11月9日,美国制药巨头辉瑞公司(Pfizer)在官网发布消息称,其与德国生物新技术公司(BioNTech)合作研发的mRNA新冠候选疫苗BNT162b2在没有感染新冠病毒的参与者身上,已经证明了超过90%的有效性,效果好于预期,并且远高于美国食品药品监督管理局(FDA)所要求的50%。
对此,辉瑞公司9日回复记者的采访时称,该公司计划在11月的第三周向美FDA提交紧急使用授权,此外预计在2020年将生产5000万剂疫苗,到2021年将生产多达13亿剂疫苗。
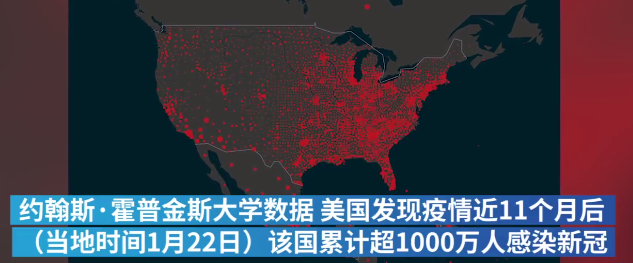
当前,全球新冠累计确诊病例总数已超过5000万,美国累计确诊超1000万。
对此,辉瑞公司9日回复记者的采访时称,该公司计划在11月的第三周向美FDA提交紧急使用授权,此外预计在2020年将生产5000万剂疫苗,到2021年将生产多达13亿剂疫苗。
当前,全球新冠累计确诊病例总数已超过5000万,美国累计确诊超1000万。
据世界卫生组织截至11月3日的统计,目前全球共有47款候选疫苗进入临床试验阶段,其中有10款已经开展了Ⅲ期临床试验。在中国,目前已有4款新冠疫苗的研发进入Ⅲ期临床试验阶段,截至10月共计接种了约6万名受试者,未收到严重不良反应的报告。
在美国,据记者此前对全球疫苗的梳理,辉瑞走在该国疫苗研发的前列。辉瑞疫苗研发团队从刚获得新冠病毒基因组测序到让第一个志愿者注射该团队研发出来的疫苗(编注:即临床试验第一阶段),仅用了不到66天时间。7月27日,该疫苗进入Ⅱ/Ⅲ期临床试验阶段,同时还得到了美国政府以19.5亿美元预定1亿剂新冠疫苗的大额订单。
9月,现任美国总统特朗普在福克斯一档电视节目中公开表示,他最看好辉瑞公司研发的疫苗,他还说这款疫苗可能率先获得批准上市。
11月9日,辉瑞疫苗有效率超90%的消息,提振了全球的信心,在这一消息的影响下,当天美股开盘大涨。辉瑞首席执行官阿尔伯特(Albert Bourla)在一份声明中说,我们在为全世界的人们提供结束这场全球健康危机的突破举措上迈出了重要一步。
然而,这一消息到底意味着什么?这款疫苗研发细节如何?临床试验到了哪个阶段?我们该如何看待疫苗有效率和最终获批上市的关系?mRNA技术研发的疫苗比传统疫苗效率更高,但目前还没有国家批准过mRNA疫苗上市,是否有证据证明我们未来可以安心使用这款疫苗?我们是否离获得一款安全有效的疫苗更进一步了?
消息公布后的第一时间,记者就上述部分问题采访了辉瑞公司。
在美国,据记者此前对全球疫苗的梳理,辉瑞走在该国疫苗研发的前列。辉瑞疫苗研发团队从刚获得新冠病毒基因组测序到让第一个志愿者注射该团队研发出来的疫苗(编注:即临床试验第一阶段),仅用了不到66天时间。7月27日,该疫苗进入Ⅱ/Ⅲ期临床试验阶段,同时还得到了美国政府以19.5亿美元预定1亿剂新冠疫苗的大额订单。
9月,现任美国总统特朗普在福克斯一档电视节目中公开表示,他最看好辉瑞公司研发的疫苗,他还说这款疫苗可能率先获得批准上市。
11月9日,辉瑞疫苗有效率超90%的消息,提振了全球的信心,在这一消息的影响下,当天美股开盘大涨。辉瑞首席执行官阿尔伯特(Albert Bourla)在一份声明中说,我们在为全世界的人们提供结束这场全球健康危机的突破举措上迈出了重要一步。
然而,这一消息到底意味着什么?这款疫苗研发细节如何?临床试验到了哪个阶段?我们该如何看待疫苗有效率和最终获批上市的关系?mRNA技术研发的疫苗比传统疫苗效率更高,但目前还没有国家批准过mRNA疫苗上市,是否有证据证明我们未来可以安心使用这款疫苗?我们是否离获得一款安全有效的疫苗更进一步了?
消息公布后的第一时间,记者就上述部分问题采访了辉瑞公司。
计划在11月第三周向美FDA提交紧急使用授权
记者:可以简单介绍一下辉瑞和BioNTech目前正在合作研发的这款mRNA疫苗的情况吗?
辉瑞公司:我们的BNT162项目是基于BioNTech的专利mRNA技术,这是一种新型的技术平台,提供了效率和灵活性,从疫苗开发的速度和它所支持的前所未有的试验设计中可以明显看出这一点。
辉瑞公司和BioNTech SE签署了一项全球合作协议(不包括中国,BioNTech与中国的复星医药的合作属于另一范畴),共同开发BioNTech潜在的、基于mRNA的新冠病毒疫苗项目BNT162,旨在预防新冠感染。我们正在以前所未有的速度开发、测试和制造这种潜在的基于mRNA的疫苗,并利用数十年的科学专业知识来开拓疫苗的发现和开发领域,以应对这一全球性健康危机。如果辉瑞与BioNTech的合作最终研发出一种安全有效的疫苗,其目标便是在全球范围内提供疫苗。
辉瑞之所以选择基于mRNA技术的疫苗,是因为该技术具有高效、安全、快速开发和生产的潜力。由于mRNA平台在修改与病毒序列相匹配的编码抗原方面的效率高,以及在任何需要时重复给药的潜在能力,基于该技术研发的疫苗对于(解决)新冠大流行可能具有特殊的效用。
记者:能否进一步介绍一下这款疫苗的研发团队目前所达到的成果以及Ⅲ期临床试验的现状?
辉瑞公司:根据Ⅲ期临床研究中由外部独立的数据监测委员会(DMC)于11月8日进行的第一次也是目前唯一一次中期疗效分析(编注:所谓中期分析是在接种了两剂疫苗或安慰剂的43000多名志愿者中,对94名新冠确诊病例进行研究)显示,确定了这款疫苗在没有SARS-CoV-2(新冠病毒)感染证据的志愿者中被证明对(预防)COVID-19(新冠肺炎)有效。
首次中期疗效分析评估了94例已确诊的COVID-19病例,这些患者均为16至85岁的无SARS-CoV-2感染史的志愿者。
在首次中期疗效分析中,在没有SARS-CoV-2感染证据的志愿者中,发现候选疫苗对COVID-19的预防效果超过90%。
该研究将按计划继续进行,直到累计至少164例病例后进行最终的一级和二级终点疗效分析。
记者:在疫苗研发之外,辉瑞向美国监管部门提出紧急批准申请之后的下一步计划是什么?新闻称,目前辉瑞还需要约4.4万人规模的临床试验的安全性数据,能否介绍一下今后达到这一步的具体步骤有哪些?是否有计划在未来几周内分享成千上万名参与者产生的其他功效和安全性数据?
辉瑞公司:我们计划在达到所需的安全里程碑后不久,立即向美国食品药品监督管理局(FDA)提交紧急使用授权(EUA),目前预计将在11月的第三周进行。此外,在志愿者获得二次免疫后,我们将继续对他们是否得到长期保护进行监控,并持续收集两年的安全性数据。
mRNA疫苗尚无商业化先例,质量如何保障?
记者:能否介绍一下辉瑞目前跟美国政府以及各个国家和企业的合作情况?哪些国家或机构预订了辉瑞疫苗,分别花了多少钱预订了多少剂量?
辉瑞公司:根据目前的预测,我们预计在2020年将生产多达5000万剂疫苗,到2021年将生产多达13亿剂疫苗。如果我们的候选疫苗研发成功,我们将按供应协议在2020年交付部分剂量给各个国家,并按比例分配2020年的可用剂量。
将剂量分配给一个国家内的适当人群是地方政府根据相关卫生当局指南制定的决定。我们致力于与政府合作,以支持公共卫生需求,但我们认为,应与全球公共卫生准则保持一致,优先考虑一线卫生保健工作者,基本工人,免疫力低下的人,疗养院和公共安全官员。
记者:mRNA疫苗尚无商业化先例,技术和生产工艺以及物流方面仍有待进一步验证,辉瑞如何克服这一难题,什么样的标准可以让我们安心使用mRNA疫苗?
辉瑞公司:辉瑞公司是一家公认的、可靠的跨国疫苗生产商,为165个以上的国家提供疫苗。如今,辉瑞公司生产了超过2亿剂疫苗,并且是世界上最大的无菌注射剂供应商之一,每年生产超过10亿单位的无菌疫苗。辉瑞有信心迅速扩大生产能力和分销基础设施,利用美国和欧洲的多个生产基地,带来大量高质量的COVID-19候选疫苗。
我们坚持我们的承诺,只有经过设计和实施符合专家监管机构(如FDA)要求的Ⅲ期临床研究,在证明安全性和有效性后,我们才会提交批准或紧急使用授权。
试验的进展由辉瑞和一个独立的外部数据监测委员会(DMC)密切监控。试验调查员还负责监测受试者的健康状况,作为试验的一部分,试验参与者有定期计划的随访。
我们看到全世界都在关注科学创新的作用,这是一个很好的机会,可以让人们了解生物制药行业和整个科学生态系统的工作,从而推动潜在治疗方法和疫苗研发的发展。
考虑到重要的公共卫生问题和透明度的重要性,我们已经提供了清晰的新冠疫苗研发时间表,与所有其他疫苗一样,必须在三个方面证明疫苗成功有效,我们才能寻求批准疫苗供公众使用,这三个方面是:
首先,必须证明疫苗有效,这意味着它至少可以帮助大多数接种疫苗的人预防COVID-19疾病。
第二,同样重要的是,必须证明疫苗是安全的,并具有成千上万名接种者的可靠安全性数据。
最后,我们必须证明疫苗可以始终以最高质量标准生产。
记者:辉瑞是否参与了“新冠肺炎疫苗实施计划”(COVAX)?
辉瑞公司:辉瑞坚定地致力于为全世界所有人提供公平且负担得起的COVID-19疫苗。我们认为,这是一项集体责任,需要公共和私营利益攸关方采取高度协调和协作行动,以结束COVID-19大流行。
在认识到这场新冠大流行的性质后,我们认识到有必要建立一个全球机制,以确保全球能够迅速、公平地获得安全有效的COVID-19疫苗。我们支持建立COVAX,使全世界的人都能公平获得疫苗。
我们还支持在COVAX中纳入预先市场承诺(AMC),作为为低收入和中低收入经济体采购COVID-19疫苗的融资机制。
每天资讯
- 价格翻几倍!国产葡萄被包装成“日本阳光玫瑰” 2024.10.21
- 景区通报4名初中生跨越挡浪墙因涨潮被困:2人获救,1人死亡1人失联 2024.10.21
- 中国驻缅甸曼德勒总领馆遭爆炸袭击,外交部回应 2024.10.21
- LPR迎来年内第三次调整!将影响你的房贷! 2024.10.21
- 长春高空抛物致死案:核准抛砖男子死刑,立即执行! 2024.10.21
- 韩国外交部召见俄罗斯驻韩大使,抗议朝鲜派兵援俄 2024.10.21
- 东部战区回应美、加军舰过航台湾海峡:全程跟监警戒,依法依规处置 2024.10.21
- 无锡江阴通报贩婴事件:婴儿被解救,相关犯罪嫌疑人被采取刑事强制措施 2024.10.21
- 消息称“萨德”已在以色列投入使用,以官员:对伊朗的回应是“板上钉钉”! 2024.10.21
- 今年前三季度中国GDP同比增长4.8% 2024.10.18
相关阅读:
[责任编辑:]
一周评讯版权及免责声明:
①凡本网注明来源:“一周评讯”的所有作品,版权均属于一周评讯,未经一周评讯协议授权不得转载、链接、转帖或以其他方式发表,已经一周评讯授权的媒体、网站,在使用时必须注明来源“一周评讯”。
②如本网转载稿涉及版权等问题,请作者来电或来函与一周评讯联系,我们将及时处理解决。联系方式:xzgxjilin@vip.sina.com
精华推荐
 刚刚,工行、农行、中行、建行、交行、邮储银行,全部官宣“降息”!20万元定存三年,利息少1500元
刚刚,工行、农行、中行、建行、交行、邮储银行,全部官宣“降息”!20万元定存三年,利息少1500元 重磅!水资源税即将全面实施,覆盖31个省份!对水价有何影响?专家解读
重磅!水资源税即将全面实施,覆盖31个省份!对水价有何影响?专家解读 国足赢了!
国足赢了! 国考报名、笔试时间,定了!
国考报名、笔试时间,定了! 东部战区开展“联合利剑—2024B”演习
东部战区开展“联合利剑—2024B”演习 多家银行“剧透”存量房贷利率调整细节:谁可以调?下调多少?
多家银行“剧透”存量房贷利率调整细节:谁可以调?下调多少? 今日,重阳节!
今日,重阳节! 2024年诺贝尔化学奖揭晓!三位科学家获殊荣
2024年诺贝尔化学奖揭晓!三位科学家获殊荣 2025考研预报名,今日启动!
2025考研预报名,今日启动! 今日,寒露!
今日,寒露!
新闻排行
- 藏族汉子果绒旦珠和他的天珠收藏
- 习近平:进一步发展中医药
- 关于全面依法治国,总书记的最新公开...
- “钻石公主”内幕揭露者,“恐惧让人...
- 美国传来新冠疫苗的好消息
- 刷一下脸,你的房子就成了别人的
- 专访李兰娟:疫后去过武汉三次,发展...
- “南大碎尸案”受害者家属起诉学校,...
- 什么时候可以摘口罩?张伯礼最新判断!
- 国防部表态:中国必定实现完全统一
推荐图片

价格翻几倍!国产葡萄被包装成“日本阳光玫瑰”

LPR迎来年内第三次调整!将影响你的房贷!

韩国外交部召见俄罗斯驻韩大使,抗议朝鲜派兵援俄

恭喜范伟、赵丽颖!获奖名单揭晓

消息称“萨德”已在以色列投入使用,以官员:对伊朗的回应是“板上钉钉”!

刚刚,工行、农行、中行、建行、交行、邮储银行,全部官宣“降息”!20万元定存三年,利息少1500元



















 公安备案号:22010702000136
公安备案号:22010702000136